D-グルコース(ブドウ糖)の重合体で、おもに動物の細胞中に存在する貯蔵多糖類。1857年にフランスのC・ベルナールが肝臓成分として発見した。ヒトの肝臓中には、その乾燥重量の約6%、筋肉中には0.6~0.7%程度含まれ、筋肉が運動するときに消費される。バクテリアやカビなどにもみいだされる。グリコーゲンは白色粉末で、無味無臭、水に溶けるがエタノール(エチルアルコール)やアセトンには溶けない。ヨウ素を加えると褐色ないし赤ぶどう酒のような色になる。肝臓を擦りつぶしてトリクロロ酢酸で抽出し、その液にエタノールを加えると、粗(そ)グリコーゲンが白色沈殿物として得られる。構造は、グルコースがα(アルファ)-1,4結合で十数個結合した直鎖が、相互にα-1,6結合で複雑につながったものである。分子全体としては枝分れの多い球状の形をとり、分子量は数百万である。構造がアミロペクチンに類似しているが、直鎖部分がアミロペクチンに比べて短い。
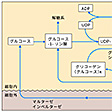
グリコーゲンの生合成は、グリコーゲンシンターゼという酵素によって触媒される。この酵素はウリジン二リン酸(UDP)グルコースからグルコース1分子をグリコーゲン鎖の末端に運び、直鎖状に延長していく。このとき新たに生ずるグルコシド結合は、α-1,4結合である。枝分れ部分のα-1,6結合は、別の酵素アミロ-1,4→1,6-トランスグリコシダーゼの働きによって生ずる。すなわち、適当な位置でα-1,4結合を切断し、生じた断片を分子の他の部分にα-1,6結合として移すわけである。また、グリコーゲンは細胞内ではホスホリラーゼ(フォスフォリラーゼ)という酵素によって分解され、グルコース-1-リン酸を生成する。さらに、種々のアミラーゼもグリコーゲンを分解する。
細胞のエネルギー源となるグルコースを、安定で、しかも必要に応じてすぐ取り出せるような形で貯蔵しておくことが、グリコーゲンの機能であり、その生合成は細胞がエネルギー源を倉庫に蓄えることであるし、分解は倉庫から運び出すことを意味する。したがって、グリコーゲンの生合成と分解の速度がどのように調節されているかということは、エネルギー代謝の制御という面から、きわめて興味ある問題である。その機構のうち、分解の促進、合成の抑制に関しては次のようになる。エピネフリン、グルカゴンなどのホルモンが細胞膜の受容体に作用すると、GTP(グアノシン三リン酸)結合タンパク質の活性化を介してATP(アデノシン三リン酸)からサイクリックAMPをつくる酵素が活性化される。サイクリックAMPはタンパク質をリン酸化する酵素群を活性化し、その働きでホスホリラーゼが活性化され、グリコーゲンシンターゼが不活性化されるわけである。
食肉では、肉の熟成の途中でグリコーゲンが解糖作用で分解され乳酸となるので、グリコーゲン含量は普通0.5%以下であるが、馬肉はそれを多く含んでいるのが特徴で数%に及ぶ。また肝臓では条件によって異なるが、牛・豚では3~4%である。貝類にも含まれ、とくにカキは5%に及ぶ。植物、微生物にも存在し、スイートコーンや糖質米などはデンプンとともに植物グリコーゲンを含む。