原子の内部構造およびその性質を示す模型。古代ギリシアの時代から物質はそれ以上細分できない最小単位から成り立っていると考えられ、それは原子とよばれた。19世紀後半になって、物質溶液の電気分解や、真空放電で現れる陰極線、また振動数の高い光を金属のような物質の表面に照射したとき電子が飛び出す光電効果などから、原子中には電子が存在するものと考えられた。しかし、電子と正の電荷をもった重い成分がどんな状態で存在するのかは20世紀初頭に至るまで明らかでなかった。
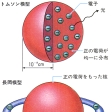
このような時期(1904)に、時を同じくしてJ・J・トムソンと長岡半太郎によって二つの仮説が提出された。トムソンは原子を、半径がおよそ10-8センチメートルの球状であると考えた。そして、正の電荷が均一に分布し、電子はこの正の電荷を打ち消すように一様に分布しているとした。それらの電子はそれぞれの安定な平衡点の周りに振動し、その結果光を放出して元の安定な状態に戻るということで原子から光が出てくることを説明できた。長岡模型はこれとは対照的に、正の電荷は原子の中心に集中していて、その周りを電子が環状に取り巻いているとした。長岡は力学的にこのような状態が存在しうることを示したが、マクスウェルの電磁理論によれば運動している電子は制動放射を放出してエネルギーを失うから、この電子の状態は不安定になる。この模型では原子の大きさ10-8センチメートルが何を基準にして決められたかも明白でない。このようなことから一般には受け入れられなかった。しかし、これらの模型は原子物理学発展史上重要な意義をもち、それぞれトムソン模型および長岡模型として引用される。
原子の構造についての重要な発見は、ガイガーとマルスデンMarsdenによって1909年に行われた、α(アルファ)粒子を金箔(きんぱく)に照射して測った散乱である。トムソン模型ではほとんどのα粒子は前方に散乱され、角度の大きいほうへ散乱される確率はきわめて小さくなり、実験と甚だしく異なることがわかった。ラザフォードはこの結果を重視し、原子の模型として正電荷が原子の中心に核になって集中しているとして、その核によるα粒子の散乱を計算した。電子による散乱は、その質量が核の質量に比べてきわめて小さく、原子の質量数の1836分の1の大きさなので無視してよい。その結果、非常によく実験結果を再現する式を得ることに成功した。これをラザフォードの散乱公式とよんでいる。彼は、原子の構造について「中心に正の電荷Ze(Zは原子番号)をもつ重い核があり、その周りにZ個の負の電荷の電子が取り巻いている」と結論した。これをラザフォードの原子模型という。しかし、この模型は長岡模型の困難をそのまま引き継ぐことになった。電子の軌道の安定性の問題や原子の線スペクトルについては古典力学の枠内では理解できないからである。そこでボーアは1913年に次の三つの仮定を導入した。
(1)原子は、古典力学で信じられているように連続的にあらゆる値のエネルギーをとりうるのではなくて、原子に特有のとびとびのエネルギーE1、E2、……だけをとることが許される。この状態を定常状態とよび、この状態では原子は光の放出や吸収を行わない。
(2)原子が光の放出や吸収を行うのは、原子が一つの定常状態から他の定常状態に移るときである。
(3)定常状態において電子は通常の力学法則に従って運動する。
光のエネルギーは、光量子説によれば、光量子を単位としその整数倍の値だけが許される。原子から出る光のエネルギーもとびとびの値であることから、原子のエネルギー準位もとびとびの値だけが許される。このようにとびとびの値だけしか許されないのが量子的な考えの特徴で、量子的に許される状態を決める条件を量子条件という。ボーアはこの三つの仮定を置くことによって水素原子のエネルギー準位を決定し、バルマー系列として知られる一連のスペクトルの説明に成功した。三つの仮定に基づいて原子の構造を記述する方法をボーアの原子模型という。
[村岡光男]