
《同》タンパク質.生物体を構成する主成分.生細胞では水 (約70%) に次いで15~18 %を占める主要な高分子群であり,ヒト,シロイヌナズナ,大腸菌ではそれぞれ約2万,1万,4400種の蛋白質がみられる.その機能は,触媒(酵素),構造・骨格,収縮・弛緩,輸送,ホルモン,防御,電子移動,受容体,抑制因子,シャペロン,貯蔵,毒素など多岐にわたり(protein universe),秒レベルから数カ月程度の寿命をもつ. 20種のα–アミノ酸(19種のL–アミノ酸とグリシン)で,ペプチド結合により連結してペプチド鎖を生成し,アミノ酸配列に対応した高次構造の形成と必要な修飾を経て一定の安定性と活性をもつ分子に成熟する.古細菌のメタン生産菌では,セレノシステイン,ピロリシンが21,22番目のアミノ酸として使われる.アミノ酸のみで構成される単純蛋白質のほか,機能発現に不可欠な成分を結合する複合蛋白質として,金属蛋白質(Ca, V, Mn, Fe, Co, Ni, Cu, Zn, Se, Mo)や他種分子を結合した蛋白質がある(核蛋白質,糖蛋白質,リン蛋白質,リポ蛋白質,色素蛋白質).既知蛋白質の平均分子量は2万2000程度であり,大きなものでは筋原繊維をつくる分子量378万のコネクチン(タイチン)などがある.多くの蛋白質は水溶性で,アルブミン(水に可溶),グロブリン(稀薄塩水),グルテリン(稀薄な塩や酸),プロラミン(アルコール水)の4種に分類される.正味電荷がゼロになるpH (等電点: pI)では溶解度が下がり,凝集して沈澱しやすい.既知の分子では,塩基性から弱酸性域にpIをもつものが多い.蛋白質は,一次構造(ペプチド鎖)が二次構造(α–ヘリックス,β–構造,β–ターン)を形成し,それらが折り畳まれて三次構造を組み立て,高次構造を完成させる.この段階で単量体は機能を獲得する.さらに高次の四次構造をつくる蛋白質は,同種または異種の分子と会合してオリゴマーを構成し,高次構造を完成させる.蛋白質分子は,少なくとも1個のドメインをもち,必要に応じてモチーフ(二次構造が形成するサブ構造)やモジュール(ドメインより下位の構造単位.平均15残基ほどの連続した残基からなるコンパクトな構造で,しばしば機能の単位にもなる)をもつ.これらの有機的な連携は高次の分子機能と効率的な発現を支える.成熟した蛋白質は,酸,アルカリ,尿素,グアニジン塩酸塩,有機溶媒のほか,熱,加圧により変性する.変性温度は60°C前後が多く,高度好熱菌では100°C前後である.腸炎ヴィブリオの溶血毒素のように,55°C前後で凝集・失活するが90°C前後で毒性を回復する例もある.コラーゲンの熱変性で生じるゼラチンなどの二次産物は誘導蛋白質(inducing protein)という.蛋白質の分子構成,分子量,アミノ酸配列,修飾アミノ酸の種類と位置は,蛋白質とペプチド断片の質量分析,電気泳動,エドマン分析,超遠心分析により確定する(プロテオミクス).静的・動的な立体構造情報は,X線結晶解析,核磁気共鳴,電子スピン共鳴,中性子散乱,ラマン散乱,円偏光二色性,カロリメトリーなどにより収集する.蛋白質の検出には,呈色法(ビウレット反応,ニンヒドリン反応),紫外吸収スペクトル,特異抗体法のほか,SDS–ゲル電気泳動では染色法(CBB)や銀塩法を用いる.細胞や組織内の挙動は,標識蛋白質(GFP,同位元素,抗体,アビジン–ビオチン結合など)と高性能の測定装置(蛍光・電子・レーザー顕微鏡,NMR)を用いて追跡する.
タンパク質は,生物体を構成するもっとも基本的な物質であり,さまざまな重要な働きをしている。細胞内外に見られる種々の構造は,主としてタンパク質により形成されるし,生物に必須の化学反応を触媒する酵素は,タンパク質でできている。そして,生体運動,神経系の活動,物質の輸送,免疫反応などもタンパク質が行っている。すなわち,タンパク質の第1の特徴として,その機能性をあげることができる。
また,タンパク質はおのおのの生物種に固有のものであり,生物種の特徴はタンパク質により決まっている。タンパク質は,人間をはじめとしてすべての動物の栄養分として重要なものである(タンパク質の栄養的側面については〈栄養〉の項目を参照)。しかし,われわれが牛肉を食べても,牛肉のタンパク質がそのまま体内に入り,筋肉になるのではない。牛肉のタンパク質は,消化管内で構成成分であるアミノ酸にまで分解された後,体内に吸収される。生物の体は,これらのアミノ酸を遺伝情報(核酸の塩基配列)に従ってつなぎ,それぞれに固有のタンパク質を合成するのである。ゆえに,タンパク質の第2の特徴はその特異性である。
DNAが太さ20Åの二重らせんの糸という均一な構造をもつのに対し,タンパク質の立体構造は種類により,鎖の折りたたまれ方も全体の外形もひじょうに多彩である。DNAはどれをとってみても情報の貯蔵・複製・発現という限られた同一の機能しかもたないのに対し,タンパク質は機能的に分化しており,種類により異なるさまざまな機能を果たす。これが構造上の多様性にも表れているのであろう。DNAについては一般論で多くのことを説明できるが,タンパク質は各論を語らないかぎり,その豊かさと精妙さを説明できない。このように,タンパク質の第3の特徴は,その多様性である。
細胞の“生きている”成分である原形質は,水分を除くと主要な部分はタンパク質でできている。したがって,100年以上前の人々が,生命の神秘を解く目的で,まずタンパク質の研究に着手したのは当然であった。タンパク質を意味するproteinという語がギリシア語で“第1の”という意味をもつprōteiosに由来するのも,このような背景から考えると理解できる。しかし,19世紀から20世紀初頭の学界では,まだいろいろと混乱した考えがみられた。たとえば,〈タンパク質は生きているから決まった構造をもたないはずだ〉〈種々のタンパク質は一つの化学式で表される〉〈数万から数十万という大きな分子量をもつ化合物などありえない〉〈タンパク質の構造は単純な構造の繰返しである〉などである。
表
タンパク質の構造は一次から四次までの段階に分けて記述されることが多い。一次構造とはいわゆる化学構造で,アミノ酸がどの順序に結合しているかをいう。一般にタンパク質はプロリン残基(図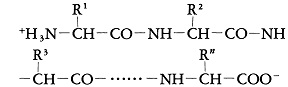 ここで,この式の左端はアミノ末端,右端はカルボキシル末端,-CO-NH-はペプチド結合,-NH-CHRi-CO-はアミノ酸残基,化学構造に注目したとき全体はポリペプチド鎖と呼ばれる。また,Riを側鎖,Ri以外の部分を主鎖,Riの結合する炭素原子をα炭素原子(Cα)という。重合度nは個々のタンパク質により異なり,およそ数十から数千の範囲にあるが,平均300程度である。アミノ酸残基は基本的には図
ここで,この式の左端はアミノ末端,右端はカルボキシル末端,-CO-NH-はペプチド結合,-NH-CHRi-CO-はアミノ酸残基,化学構造に注目したとき全体はポリペプチド鎖と呼ばれる。また,Riを側鎖,Ri以外の部分を主鎖,Riの結合する炭素原子をα炭素原子(Cα)という。重合度nは個々のタンパク質により異なり,およそ数十から数千の範囲にあるが,平均300程度である。アミノ酸残基は基本的には図
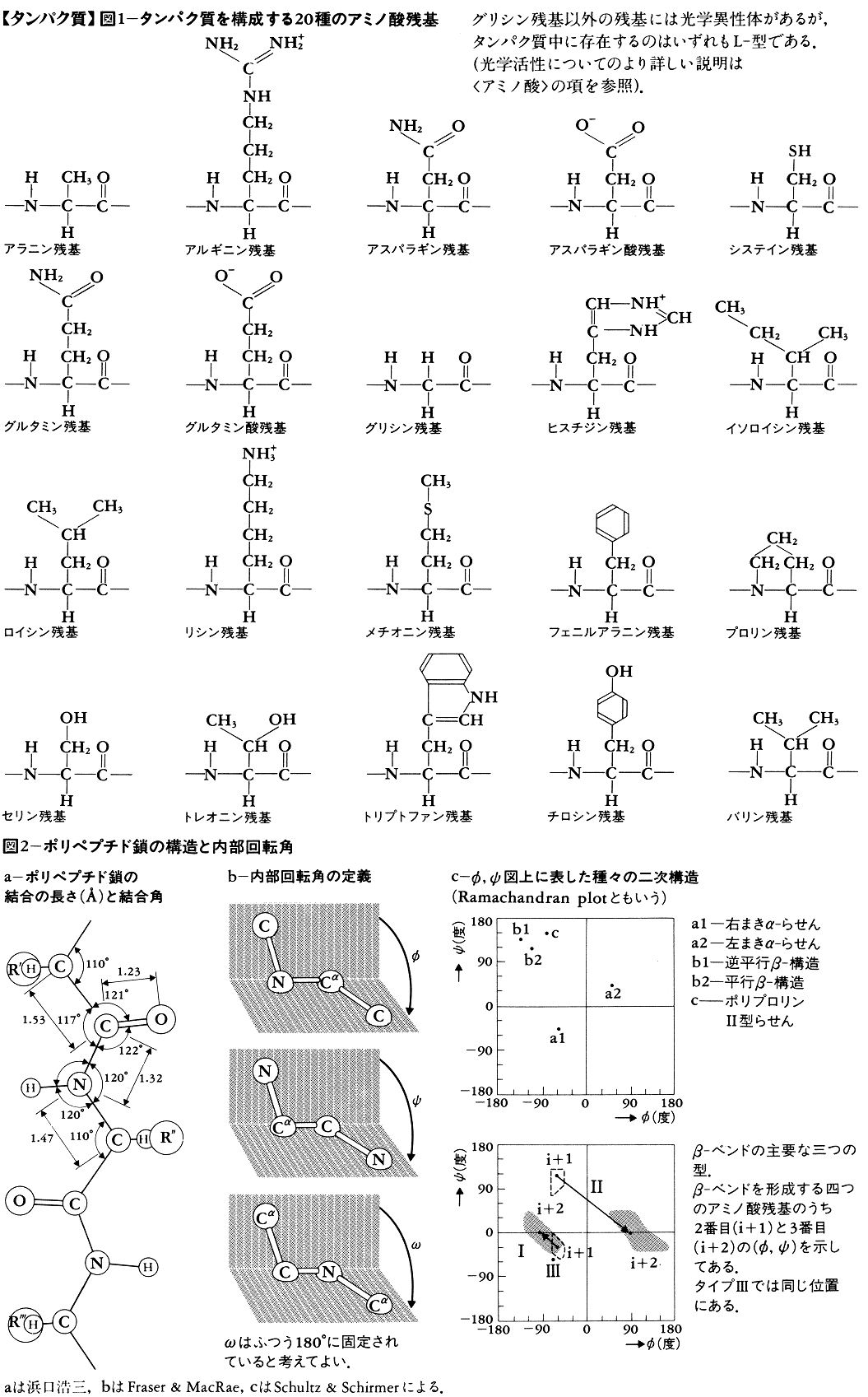
二次構造とは多くのタンパク質に見いだされる部分的かつ特徴的な立体構造のことである。タンパク質中の原子間結合の長さと結合角(一つの原子から出る結合間の角度)は,一次構造によらずほぼ一定とみなしてよい(図
ポリペプチド鎖1本の全立体構造をタンパク質の三次構造という。完全な三次構造は,主鎖と側鎖を含む全原子の三次元の位置座標で表される。ただし,水素原子の位置は,タンパク質の三次構造を決めるX線解析法では普通見えない。実際に図示する場合,全原子の位置を描くと複雑すぎて見にくくなるので,α炭素の位置のみを示したり(図
タンパク質のあるものは複数のポリペプチド鎖から成る。この場合,ポリペプチド鎖の数とこれらの間の幾何学的位置関係を合わせて四次構造という。三量体のタンパク質も少数あるが,ポリペプチド鎖の数は2,4,6など偶数が普通である。
タンパク質に熱や圧力を加えたり,溶液のpHを変えるとか変性剤を加えるなどの操作をすると,一次構造は変化しないが二次以上の高次構造が変化してタンパク質が活性を失うことがある。これをタンパク質の変性という。変性に伴いタンパク質が凝固・沈殿することもまれではない。また,変性したタンパク質を元の環境に戻したときに高次構造と活性が回復することをタンパク質の再生という。塩酸グアニジンなどの強い変性剤中では,二次構造は完全に消失し,合成高分子などに見られるランダムコイルの状態になる。このような状態からでも多くの場合再生が可能なので,タンパク質の二,三次および簡単な四次構造は,一次構造すなわちそのタンパク質のもつ遺伝情報のみにより決まると考えられている。
それでは,アミノ酸配列が与えられたとき,そのタンパク質の種々の性質をどの程度予言することができるだろうか。アミノ酸残基により,種々の二次構造を作りやすい,あるいは作りにくいものがあることが経験的に知られている(表
活性ある天然の状態では,タンパク質の立体構造はさまざまな非共有結合により安定化され,エンタルピーHが小さくなっている。これに対し,変性状態ではこれらの結合はほとんど切れているが,その代りに多くの自由度を獲得してエントロピーSの大きな状態になっている。一方熱力学によると,ギブスの自由エネルギーGの小さい状態ほど安定であり,G=H-TSという関係が成立することが知られている。したがって,絶対温度Tの低いときは天然の状態が,また高いときは変性した状態が安定になる。また,熱変性のときある温度を境にこの二つの状態は急激に転移する。天然の構造を安定化する非共有結合として,水素結合,静電結合(塩橋),ファン・デル・ワールス力(分子間力),疎水結合などがある。このうち疎水結合はタンパク質自体でなく,溶媒の水によるものである。水の分子は水どうしと接触するよりタンパク質と接するほうが自由エネルギーが高い。このため水とタンパク質の接触面積を最小にするような,つまりタンパク質をなるべく密な構造にするような力が働く。これが疎水結合の本質である。タンパク質分子間の結合やタンパク質と他の分子(たとえば酵素と基質)の間の結合にも,上に述べた種々の非共有結合が働いているものと考えられる。
タンパク質の生合成は,遺伝情報に従ってアミノ酸を順序よくつなぐことである。その機構はかなり複雑で,多くの成分を必要とする。DNA鎖の1本を鋳型にして写しとられたメッセンジャーRNA(mRNAと略記)の塩基は三つずつくぎって読まれ,その三つ組(トリプレットまたはコドンと呼ばれる)に対してアミノ酸が一つ対応する。この対応のしかたを遺伝暗号表という(〈遺伝暗号〉の項目を参照)。mRNAは5′末端側から3′末端側に向かって読まれ,それにつれてタンパク質はアミノ末端からカルボキシル末端に向かって合成される。詳細については〈タンパク質合成〉の項目を参照されたい。
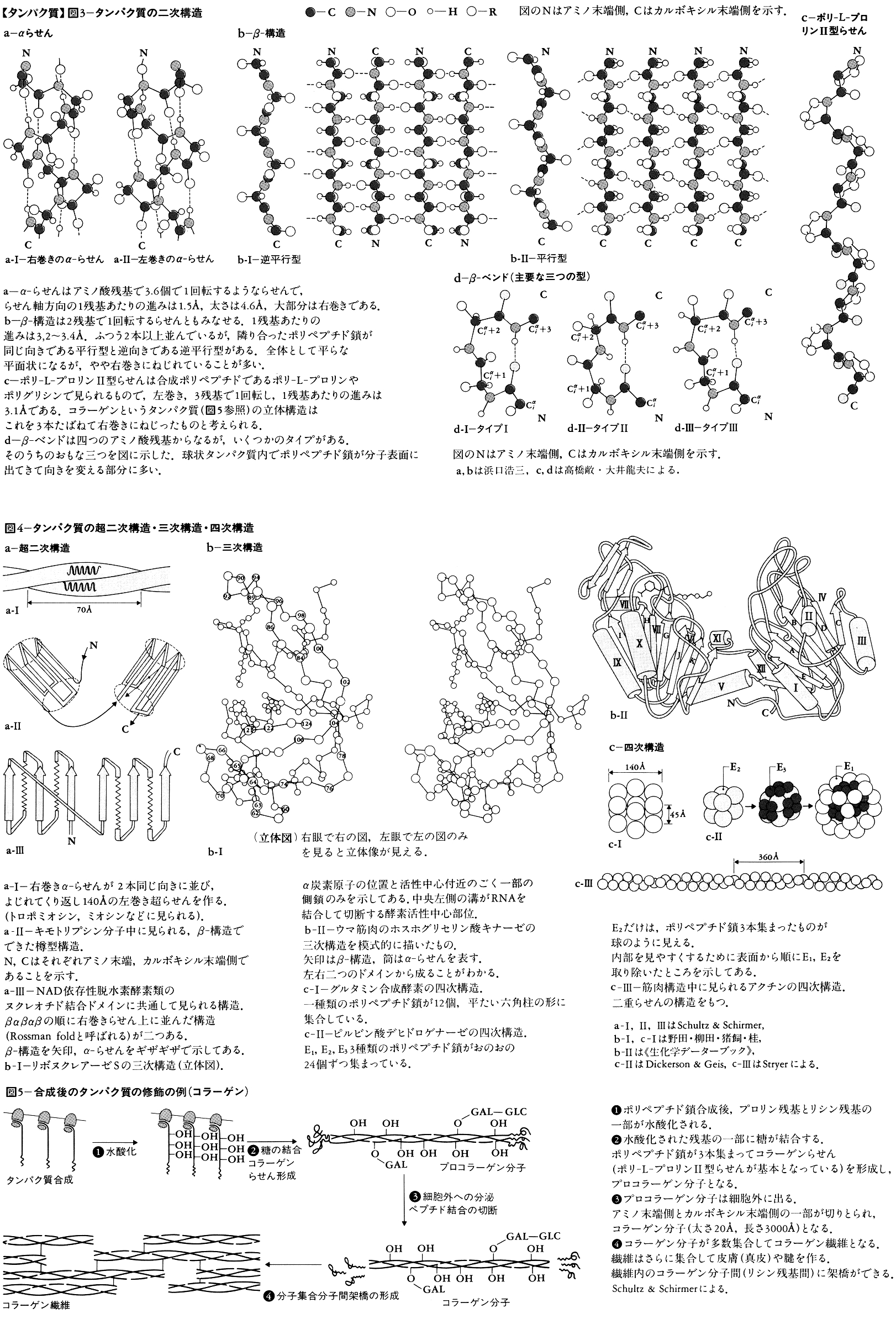
タンパク質は合成後に修飾される場合がかなり多い。その一例はペプチド結合の切断である。トリプシンなどのタンパク質分解酵素やインシュリンなどのペプチドホルモンには,切断を受けて初めて活性の出るものが多い。多くの膜タンパク質は合成時,アミノ末端にシグナルペプチドと呼ばれる部分をもつ。この部分はタンパク質が膜内に正しく組み込まれるときに必要だが,後に切り取られる。また一部の動物ウイルスでは,ひじょうに長いポリペプチド鎖が数個に切断され,おのおのが別の活性あるタンパク質になる。
側鎖やアミノ末端が修飾を受けることもある。側鎖ではメチル化,水酸化,リン酸化など,アミノ末端ではアセチル化,ピログルタミル化などが起こる。リン酸化により活性の調節を受ける酵素は多い。また,ある種の発癌遺伝子には,タンパク質をリン酸化する活性があり,注目されている。広い意味では,糖タンパク質における糖の結合や,酵素タンパク質への補欠分子族(チトクロムcのヘムなど)の結合も,この部類に入るだろう。また,二つのシステイン残基のSH基が酸化され,分子内に-SS-(ジスルフィド)結合の架橋を作る例は,細胞外で働く酵素に多い。皮膚や腱のコラーゲンでは二つのリシン残基の間に,血液凝固産物のフィブリンではグルタミン残基とリシン残基の間に,それぞれ分子間架橋ができる(図
ひじょうに多数の種類から成るタンパク質を分類しようとする試みはいろいろある。ポリペプチド鎖のみから成るものを単純タンパク質simple protein,他の物質と結合して(非共有結合も含める)存在するものを複合タンパク質conjugated proteinという(表
タンパク質機能の作用機構に関しては,どのような特徴が挙げられるだろうか。その第1は結合における立体相補性である。タンパク質とタンパク質,およびタンパク質と他の分子との結合面では,凸凹が互いに裏返しになっており,余分なすきまができないようになっている。これは結合の特異性を高める役割を果たしている。図
第2に反応基の最適配置がある。酵素が基質を結合したところを見ると,基質の攻撃すべき部分の近傍に酵素の反応基(Ser,His,Cys,Asp,Gluなどの側鎖,金属イオン,補酵素など)が存在して,反応の効率を高めている。分子間の結合面でも単に立体的な凸凹だけでなく,しかるべき所にしかるべき側鎖や主鎖が配置され,正と負の電荷による結合(塩橋)や-NH(または-OH)と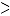 C=Oによる水素結合などが形成できるようになっている。この実例は図
C=Oによる水素結合などが形成できるようになっている。この実例は図
第3には結合の誘導適合induced fitが挙げられる。溶液中でのタンパク質の立体構造は,わずかに異なる多くの構造の間を移り変わってゆらいでいる。ところがこれに基質などが結合すると,結合が可能な構造のみに固定される。このため,結果的には基質が酵素の構造を結合に適したように変えたことになる。
そして第4にアロステリック効果がある。これはタンパク質の一部分に他の分子が結合すると,離れた部位の構造や活性が変わるという現象である。生体内においてはこれはさまざまな面で重要な役割を果たしている。その一つは酵素のフィードバック阻害で,代謝の最終産物が代謝系の始めの方の酵素に結合して活性を阻害し,むだな産物の生産を防ぐ役割を果たしている。また,アロステリック効果はヘモグロビンによる酸素運搬にも使われている。ヘモグロビンは1分子当り4分子の酸素を結合するが,一つめの酸素分子を結合するとアロステリック効果で他の結合部位へと影響が及び,二つめ以降の酸素結合がより容易になる。このため,酸素分圧に対し酸素結合量はS字型曲線となり,生理的な酸素分圧の近傍で酸素分圧の小さな変化に対してより多量の酸素の結合・解離ができるようになっている。アロステリック効果の機構は,連結した歯車に次々と動きが伝わるように,タンパク質の一部分に起こった構造変化が順々に隣接した部分を伝わっていくことのようである(図
以上はある程度実験により確認された機構だが,推測としては他にもいくつかの機構が考えられている。たとえば,タンパク質には多くの解離基や電気双極子をもつ基があるが,これらの分布により活性中心に強い電場が生じ,それが基質を分極させて酵素反応を助けているという説がある。また,溶液中でタンパク質分子は種々の振動をしているが,そのうちの一つの振動を使って基質を食いちぎっているという説がある。さらに,溶媒分子が酵素に衝突すると,そのエネルギーはこの振動に集中的に集められるという考えもある。中には,酵素は基質を追いかけて捕らえるのだという人もいる。タンパク質はひじょうに効率よく仕事をするだけでなく,環境の変化に敏感に受け答えし,まさに生きているようである。これが研究者の想像力を刺激し,種々の考えを生む。この意味ではタンパク質観は現代でもまだ揺れ動いている。推測の考えの中には,将来,否定されるものもあるに違いない。しかし,他方ではもっと精巧な作用機構が発見される可能性も十分にあるといえよう。
タンパク質の研究法を表
いろいろな生物から同じタンパク質を取り出して,そのアミノ酸配列を比べると進化の道すじがわかる。なぜなら,アミノ酸配列の違いは,種が分かれて以来の突然変異の蓄積によるので,進化の時間を計る時計となるからである。図
人工的にアミノ酸をつなげてタンパク質を化学合成することはまだ難しく,特別な技術とタンパク質の種類に合った方法が必要である。かりにアミノ酸一つをつなげるときの正確さを99%としても,100個つなげると63%,300個つなげると95%がまちがった産物になってしまうからである。しかし,アミノ酸を10個程度つなげたペプチドは,固相合成法で比較的容易に合成できる。これは洗浄や溶媒交換を容易にするために,樹脂の上でアミノ酸をカルボキシル末端側から順につないでいく方法である。操作としては,(1)樹脂に結合したペプチドのアミノ末端(第1段目は樹脂そのもの)に,アミノ基をBoc(t-ブトキシカルボニル)基で保護したBoc-アミノ酸のカルボキシル基を,縮合剤を用いて結合する。(2)トリフルオロ酢酸でBoc基を外すことを繰り返す。
現在,構造研究では一次構造決定の微量化,膜タンパク質や構造タンパク質の三次構造決定などがおもな目標とされている。タンパク質の作用機構に関しては,立体構造を見ての推論から実証へ向けての努力が,反応中間体の立体構造決定などを中心に進められるであろう。タンパク質の運動に関する実験と理論計算から興味ある結論の出る可能性もある。また一次構造のデータが莫大な量蓄積されるので,それからいろいろと有用な情報を取り出すことも行われつつある。
遠い将来の目標としては,望む機能をもつタンパク質を設計することが考えられる。これには一次構造を見て機能を予言すること,およびその逆が必要になる。理論的に可能なタンパク質の数は,かりにアミノ酸300残基としても20300≒10400という超天文学的数字になる。これは,地球の誕生以来出現したタンパク質種の総数と比べても限りなく大きい。地上の生物にはないまったく新しいタンパク質で,有用な機能をもつものが多数存在することが予想される。


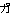 ク
ク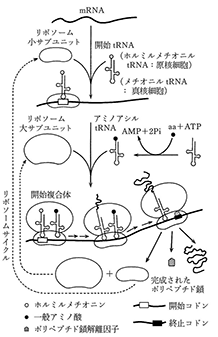 生細胞における蛋白質の合成.蛋白質は生体内で常に合成と分解の動的平衡の状態にある.各蛋白質はそれぞれ固有の速度で分解され,また新たに合成されている.細胞内で蛋白
生細胞における蛋白質の合成.蛋白質は生体内で常に合成と分解の動的平衡の状態にある.各蛋白質はそれぞれ固有の速度で分解され,また新たに合成されている.細胞内で蛋白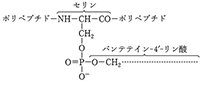 ACPと略記.《同》アシルキャリアー蛋白質,脂肪酸基運搬蛋白質.脂肪酸生合成においてアシル基の担体として機能する蛋白質.アセチルCoA,マロニルCoAからのde
ACPと略記.《同》アシルキャリアー蛋白質,脂肪酸基運搬蛋白質.脂肪酸生合成においてアシル基の担体として機能する蛋白質.アセチルCoA,マロニルCoAからのde SV40ウイルスのプロモーターに6カ所存在するGGGCGGモチーフに結合するヒトの転写因子.c-fos,TGF-β1プロモーターに存在するRCE(pRBの制御エ
SV40ウイルスのプロモーターに6カ所存在するGGGCGGモチーフに結合するヒトの転写因子.c-fos,TGF-β1プロモーターに存在するRCE(pRBの制御エ









©2026 NetAdvance Inc. All rights reserved.